干细胞—恢复光明的新生力量
2022-06-06
假如上帝给你三天光明,你最想让你的目光停留在什么地方?美国著名作家海伦·凯勒在所著《假如给我三天光明》中是这样回答的——我一定会让目光停留在珍爱的东西上,以便在未来黑暗中一一把它们回想。这是多么无奈的选择,悲壮而苍凉……而如今,随着生物科学技术的发展,干细胞开启了眼病治疗的新篇章。
针对不同眼疾的现代治疗方法日新月异。近年来,眼科专家已经在干细胞研究上投入了大量的关注。目前,干细胞已经在很多种眼部病变的治疗中得到了长足的进步。
一、近视
随着科技的发展,电视、手机和平板电脑的无处不在,丰富视野的同时,也大大减少了人们户外活动的时间,2021年7月份国家卫健委公布的数据显示,2020年我国儿童青少年总体近视率为52.7%,较2019年上升了2.5%。
近视发病的年龄越来越小,高度近视的人群也越来越多,迫切需要有效的治疗手段可以阻止儿童期近视的发展,降低近视的发病率。
间充质干细胞已成功应用于多种结缔组织再生/重建的临床应用,间充质干细胞的特性使其成为巩膜加固的理想候选细胞[1]。由于近视发展的病理机制(如图1)与干细胞特性相一致,巩膜下注射间充质干细胞可以使近视患者原本脆弱的巩膜有所增强,移植细胞有望分化成纤维母细胞,产生细胞外基质,加强巩膜,阻止眼球伸长,从而预防或阻止近视(如图2)。
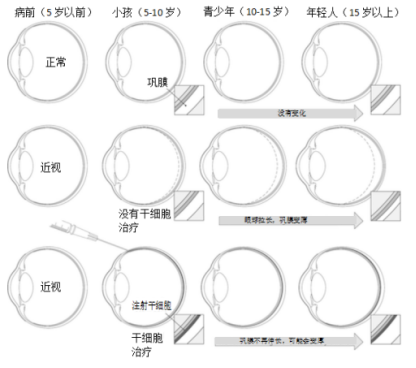
图1:严重近视发展的示意图,以及干细胞治疗在限制疾病进展中的潜在作用。注意随着时间的推移,眼轴拉长,巩膜变薄,以及在早期治疗的情况下阻止疾病进展的前景。
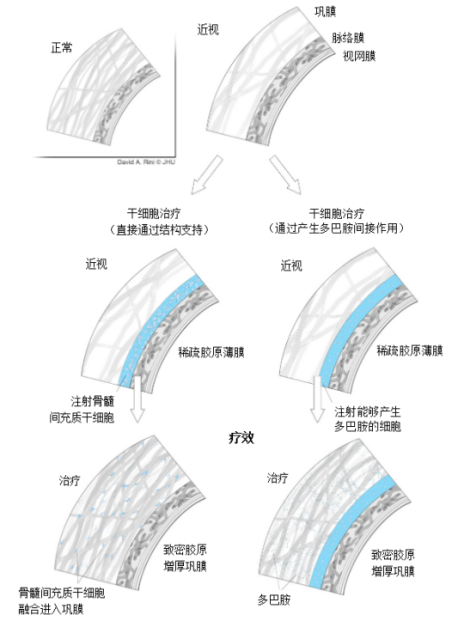
图2:应用干细胞相关疗法可以潜在地利用预防近视进展的机制。这些包括将注射的间充质干细胞与直接机械支持的巩膜结构结合,以及通过产生多巴胺间接刺激巩膜组织,从而阻止眼球伸长。
二、视网膜色素变性
视网膜色素变性(RP)是一组遗传性眼病,是由于视网膜细胞受损并最终死亡,导致视力逐渐丧失。由于视神经和视网膜神经节细胞没有再生能力,所以在受损凋亡后会造成不可逆的损伤。
间充质干细胞在退行性疾病中的主要作用机制是通过分泌生长因子调节具有旁分泌作用的微环境,它们可作为营养因子的来源,促进细胞存活并激活内在修复机制[2]。因为MSC在细胞表面不表达主要组织相容性复合体 (MHC), 这一优势允许自体或同种异体使用而没有排斥的风险,移植后,患者不需要接受任何免疫抑制治疗来预防排斥反应[3-4]。
《Research Gate》网站刊登的临床3期试验,由经验丰富的外科医生在局麻下采用被称为Limoli的视网膜修复技术(LRRT)。Limoli等人对此进行了描述[5-7],将干细胞悬液注射到移植的脉络膜和巩膜之间的脂肪组织中,手术过程中,每只眼睛都接受了500万个UC-MSC,并进行了为期六个月的随访观察(如图3,图4)[8]。
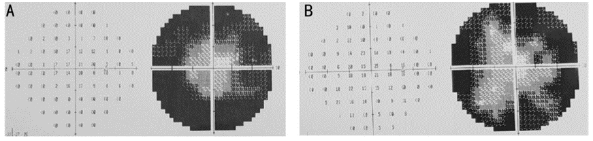
图3:患者治疗前(a)和治疗后6个月的视野测量结果(B)研究期间周围视野缺损减少。

图4:同一患者治疗前(A)和治疗后6个月多焦视网膜电图(mfERG)记录(B)彩色图和三维可视化图显示mfERG记录的改善,特别是中央环mfERG记录的改善。
2010年,美国ACT公司(advanced cell technology)获得FDA许可,利用胚胎干细胞衍生的视网膜色素上皮细胞(RPE)对治疗两种退行性眼疾病:干性年龄相关性黄斑变性(Dry age-relatedmacular degeneration,AMD)和少年型黄斑营养不良(Stargardt病)。这是FDA批准的涉及到源自人类胚胎干(hES)细胞的第二项临床试验。
2012年,该研究机构在《柳叶刀》(The Lancet)杂志发表了一篇文章《Embryonic stem cell trials for macular degeneration: a preliminaryreport》[9]。美国研究人员利用人类胚胎干细胞(hESC)治疗了两名患有不同退化性眼疾病的患者,初期数据表明hESC治疗不仅安全,且显示出了一些治疗效力。他们将hESCs诱导生成了早期骨细胞和神经组织细胞,随后这些细胞分化形成了视网膜上皮细胞,其纯度超过99%。
研究人员将大约5万个分离出来的视网膜上皮细胞注入到两名患者的视网膜下,其中一名老年女患者在其70多岁时患上了干性年龄相关性黄斑变性,而另一名中年女患者则患有Stargardt病,因而导致了二者失明。4个月后,研究人员发现RPE已被注入的视网膜上皮细胞完全取代,数据证实注入的细胞存活了下来,并很大程度上改善了她们的视力。(如表)
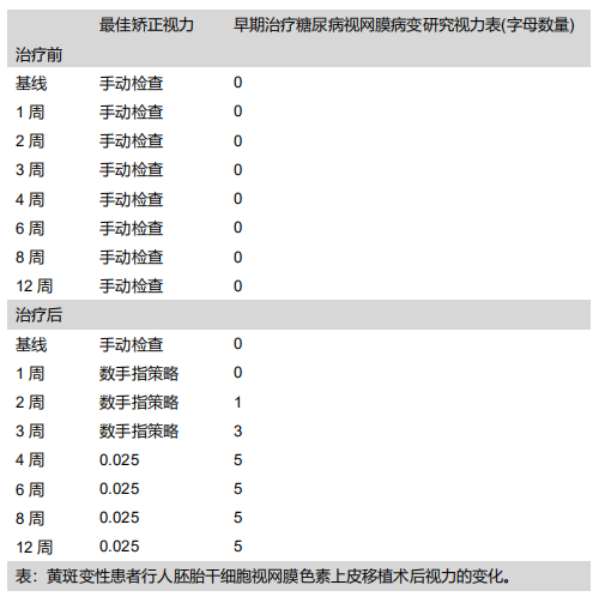
三、黄斑变性
黄斑变性通常是高龄退化的自然结果,随着年龄增加,视网膜组织退化,变薄,引起黄斑功能下降。黄斑变性分为年龄相关性黄斑变性和少年黄斑变性两种。年龄相关性黄斑变性(ARMD) 在过去几十年里发病率呈不断上升的趋势,是造成60岁以上人群失明的主要原因之一[10-11]。
黄斑变性的疾病特点在于视网膜色素上皮细胞(RPE)的丧失 ,进而使光感受器细胞(视锥、视杆细胞)等发生退行性改变;使患者逐步丧失视觉的敏锐度,无法读书看报和驾车出行。然而现阶段的临床治疗均无法根除病因,且部分患者对治疗反应差。因此人们开始探索新的黄斑变性治疗方法。通过干细胞疗法取代患者体内垂死的RPE细胞,从而在视力丧失发生之前挽救眼睛。
RPE 能够从人胚胎干细胞(human embryonic stem cells,hESCs)或人诱导多能干细胞(iPSC)分化而来[12-14]。在光感受器受到不可逆损坏之前,用干细胞分化来的 RPE 细胞补充丢失或退化的 RPE 细胞,分化出的细胞具有和RPE 细胞相似的形态,能够表达 RPE 标记物,并具有吞噬光感受器外节的能力[15]。
发表在《自然生物技术》上的一篇文章[16]描述了一种由干细胞衍生而来的视网膜色素上皮层贴片,可用于治疗因黄斑变性引起的突发性严重失明。研究人员使用专门设计的显微外科工具将贴片植入两名严重渗出性黄斑变性患者的一只眼视网膜下间隙。通过生物显微镜和光学相干断层扫描术成功植入视网膜色素上皮层贴片并存活,手术12个月后,两名患者的视力分别提高29和21个字(如图5)。这项临床研究为人胚胎干细胞RPE贴片移植作为治疗年龄相关性黄斑变性的可行性和安全性提供了依据。
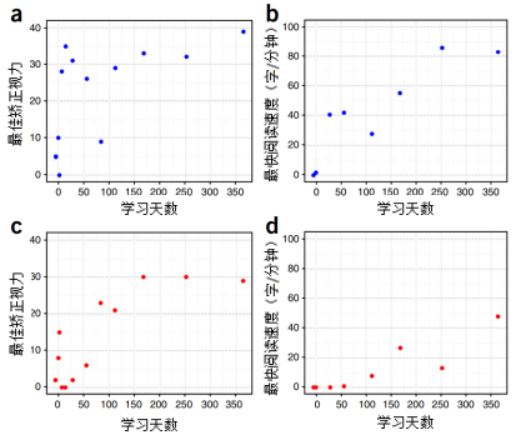
图5:病例1和2的最佳矫正视力和阅读速度
(a) 患者1的最佳矫正视力超过12个月。
(b) 患者1的阅读速度超过12个月。
(c) 患者2的最佳矫正视力超过12个月。
(d) 患者2的阅读速度超过12个月。
四、青光眼
青光眼是一种神经变性疾病,它的病理特征是视神经萎缩、视野缺损,从而导致视觉功能损害,以致视力下降,严重者可能失明。致病机理是病理性的眼压增高、视神经供血不足。
目前的治疗手段是通过药物或手术降低眼压及进行视神经保护治疗。这些手段仅能起到一定保护的作用,但不能从根本上阻止视神经损伤。
有科研人员利用间充质干细胞治疗动物视神经损伤模型发现治疗效果明显,其机制是归巢的间充质干细胞通过旁分泌作用分泌细胞因子,对损伤的神经细胞进行修复[17]。
2013年,Stem Cells杂志发表了一篇文章《Transplantation of Mesenchymal Stem Cells Promotes TissueRegeneration in a Glaucoma Model Through Laser-Induced Paracrine FactorSecretion and Progenitor Cell Recruitment》[18]。
来自加拿大的研究人员在青光眼模型中移植入间充质干细胞,通过激光诱发的旁分泌因子分泌和祖细胞增殖可以促进青光眼的组织再生。实验显示,骨髓中的间充质干细胞诱发小梁网细胞的再生,注射进眼前房比造血细胞更能有效引起眼内压(IOP)下降(p<0.001)(如图6)。此外,间充质干细胞和它们分泌的因子诱发睫状体中祖细胞池再活化,促进细胞增殖(如图7)。
激光诱发的组织重构将间充质干细胞按照预定目标导入受损区域,并使眼祖细胞也有一定的增加。该研究证实间充质干细胞及其分泌组分是开角型青光眼通过局部神经祖细胞进行组织修复的关键介质。
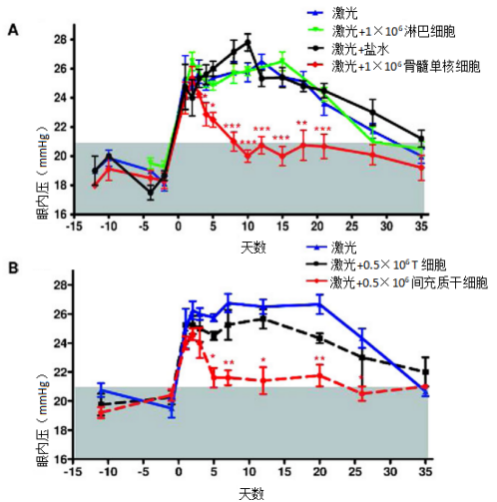
图6:MSC(间充质干细胞)诱导实验性青光眼眼压迅速恢复正常。
(A) :眼前房注射1×106 骨髓单核细胞(红色)、1×106淋巴细胞(黑色)、生理盐水(绿色),不接受额外治疗(蓝色)。灰色区域表示眼内压正常范围。眼内压报告为四个实验的平均值±SEM,每组评估12只动物。
(B) :0.5×106 T细胞(黑色)或0.5×106 间充质干细胞(红色)在激光照射后眼内注射,并如上所述进行评估。评估每组9只动物的三个实验的平均值±SEM。
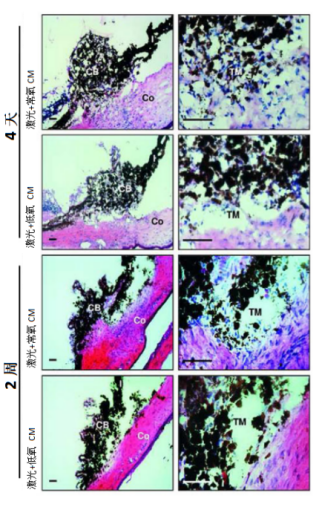
图7:激光照射常氧或低氧MSC-CM(条件培养基)后立即处理的大鼠眼前节用苏木精-伊红(H&E)染色。在MSC-CM注射后第4天和第14天进行评估。
五、白内障
白内障是指眼球内的晶状体发生混浊、由透明变成不透明,阻碍光线进入眼内,从而影响视力。早期混浊轻微或范围较小时不影响视力,而后逐渐加重至明显影响视力甚至失明。白内障引起的视力下降是无法通过配戴眼镜矫正的。世界卫生组织估计全世界有大约2000万人由于白内障而致盲,是世界排名首位的致盲眼病。
传统的治疗方法通常使用超声波软化并破碎晶状体,把晶状体冲出,随后,医生再在患者眼中植入人工晶状体,但是,术后可能会出现重症炎症和并发症,甚至可能导致不可逆性眼盲。人工晶体不仅价格不菲,更不具备灵敏且精确的生理调节能力,甚至术后常常出现眩光症状而影响视觉质量[19]。这些人工晶状体固有的缺陷促使人们去探索新的白内障治疗方法。
中山大学眼科中心刘奕志教授领衔的团队,发现眼球的晶状体上存在内源性的干细胞,并利用这种干细胞在原位再生出透明的晶状体,首次实现了人体有生理功能的实体组织器官再生,并用于临床治疗先天性白内障。这一研究结果于2016年3月发表在《自然》杂志上[20]。实验中12名2岁以内的先天性白内障患儿接受了这种全新手术方式,术后再生出功能性晶状体,并将复发率降低20倍以上,该项临床试验证实了新术式在治疗先天性白内障中的安全性和有效性,为白内障治疗提供了全新的策略,并开辟了组织再生及干细胞临床应用的新方向。

除此之外,角膜缘干细胞(limbal stem cell)、口腔黏膜上皮细胞(mucosalepithelial cells)、角膜上皮干细胞(corneal epithelial stem cell)等移植治疗角膜损伤;胚胎来源的色素上皮细胞(ES derived RPE)以及造血干细胞、间充质干细胞移植治疗于自身免疫引起的一些眼部病变等研究也正在如火如荼的进行中。
全世界的科研工作者们从未停下追逐光明的脚步,相信在不久的将来,干细胞能够治愈更多的眼疾,给眼疾患者带来光明。
参考文献:
【1】MIROSLAW JANOWSKI,Jeff W M Bulte.Concise Review: Using Stem Cells to Prevent the Progression of Myopia—A Concept.STEM CELLS 2015;33:2104–2113 www.StemCells.com.
【2】Ng TK, Fortino VR, Pelaez D, et al. Progress of mesenchy-mal stem cell therapy for neural and retinal diseases. World J Stem Cells 2014; 6: 111–119.
【3】Nauta AJ and Fibbe WE. Immunomodulatory properties of mesenchymal stromal cells. Blood 2007; 110: 3499–3506.
【4】Kyurkchiev D, Bochev I, Ivanova-Todorova E, et al. Secretion of immunoregulatory cytokines by mesenchymal stem cells. World J Stem Cells 2014; 6(5): 552–570.
【5】Limoli PG, Limoli C, Vingolo EM, Scalinci SZ, Nebbioso M. Cell surgery and growth factors in dry age-related macular degeneration: visual prognosis and morphological study. Oncotarget 2016;7(30):46913-46923.
【6】Limoli PG, Vingolo EM, Morales MU, Nebbioso M, Limoli C. Preliminary study on electrophysiological changes after cellular autograft in age-related macular degeneration. Medicine (Baltimore) 2014;93(29):e355.
【7】Limoli PG, Vingolo EM, Limoli C, Nebbioso M. Stem cell surgery and growth factors in retinitis pigmentosa patients: pilot study after literature review. Biomedicines 2019;7(4):E94.
【8】Neslihan Sinim Kahraman , Ayse Oner. Umbilical cord derived mesenchymal stem cell implantation in retinitis pigmentosa: a 6-month follow-up results of a phase 3 trial. DOI:10.18240/ijo.2020.09.14.
【9】Schwartz SD et al (2012): Embryonic stemcell trials for macular degeneration: a preliminary report,TheLancet,379(9817):713-720.
【10】Friedman DS, O’Colmain BJ, Munoz B, Tomany SC, McCarty C, de Jong PT, et al. Prevalence of age-related macular degeneration in the United States. Arch Ophthalmol 2004; 122(4): 564-72.
【11】Klein R, Klein BE, Lee KE, Cruickshanks KJ, Gangnon RE. Changes in visual acuity in a population over a 15-year period: the Beaver Dam Eye Study. Am J Ophthalmol 2006; 142(4): 539-49.
【12】Carr AJ, Vugler AA, Hikita ST, et al. Protective effects of human iPS-derived retinal pigment epithelium cell transplantation in the retinal dystrophic rat. PLoS ONE 2009;4:e8152.
【13】Cho MS, Kim SJ, Ku SY, et al. Generation of retinal pigment epithelial cells from human embryonic stem cell-derived spherical neural masses. Stem Cell Res 2012;9:101–9.
【14】Buchholz DE, Hikita ST, Rowland TJ, et al. Derivation of functional retinal pigmented epithelium from induced pluripotent stem cells. Stem Cells 2009;27:2427–34.
【15】Jakub Hanus, Fangkun Zhao, Shusheng Wang. Current therapeutic developments in atrophic age-related macular degeneration. Br J Ophthalmol 2016;100:122–127. doi:10.1136/bjophthalmol-2015-306972.
【16】Phase 1 clinical study of an embryonic stem cell–derived retinal pigment epithelium patch in age-related macular degeneration. Received 6 November 2016; accepted 28 February 2018; published online 19 March 2018; doi:10.1038/nbt.4114
【17】Chung S,Rho S,Kim G,et al.Human umbilical cord blood mononuclear cells and chorionic plate-derived mesenchymal stem cells promote axon survival in a rat model of optic nerve crush injury[J].International Journal of Molecular Medicine,2016,37(5):1170-1180.
【18】Transplantation of Mesenchymal Stem Cells Promotes Tissue Regeneration in a Glaucoma Model Through Laser-Induced Paracrine Factor Secretion and Progenitor Cell Recruitment.RenaudManuguerra-GagnÉ,PatrickR. Boulos.
【19】刘奕志,董夏.干细胞与晶状体再生.中华细胞与干细胞杂志(电子版) 2014年2月第4卷第1期 Chin J Cell Stem Cell (Electronic Edition), Feb 2014,Vol. 4, No. 1.
【20】Haotian Lin, Hong Ouyang .Lens regeneration using endogenous stem cells with gain of visual function.Nature volume 531, pages 323–328 (2016). DOI:10.1038/nature17181.




