干细胞用的越多,疗效就越好吗?
很多人都认为干细胞在使用时是越多越好,可事实真的是这样吗?在这里,可以明确的告诉大家,这个想法其实是完全错误的。
以间充质干细胞(MSC)为例,如果把MSC看作为“药品”,那么肯定存在一个范围,在这个范围内,剂量越高效果越好;然后达到一个饱和剂量后,继续提高细胞剂量,并不能带来更多的疗效,还可能引发“细胞因子风暴”,致人休克而死亡。
当大量MSC细胞涌入机体时,其产生的大量细胞因子,导致血管过度扩张、通透性大大增加而引起组织红肿、器官受损。当这些细胞因子随血液流到其它器官时也造成同样过激的免疫反应。这种失控的免疫反应往往造成多重器官损伤甚至衰竭,进而导致休克而死亡,临床上称其为“细胞因子风暴”如图1所示。
例如,心脏肌肉细胞遭受大量细胞因子侵噬,造成爆发性心肌炎或猝死;若细胞因子风暴发生在肺部[1],肺部血管扩张、组织肿胀、大量聚集免疫细胞,不仅会阻塞呼吸道,同时分泌出来的大量黏液也会把呼吸系统的管腔塞满(整个肺部都淹水了),也就是说,患者会被自己所分泌的黏液淹没,空气无法进出肺部,肺泡无法进行氧气交换,此时需要靠支持性疗法支撑,例如,插管或用叶克膜,以便撑过这场“风暴”。如果撑不过,“细胞因子风暴”就是夺命的杀手。
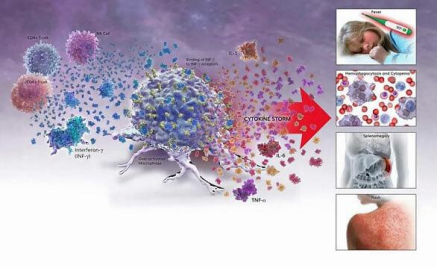
图1:细胞因子风暴
其实影响细胞的疗效因素有很多,不应只关注用量,更应该关注细胞质量和临床使用正确与否。
影响MSC相关疗效的关键因素
对于疾病在临床前的研究中,动物实验并没有充分证明MSC起效的最低剂量和最大饱和剂量,而且不同实验室的培养系统、MSC的来源属性等因素,常常导致MSC的质量存在差异,直接影响了MSC的动物实验和临床研究的结果。因此,MSC的临床前研究的数据并不能很好地指导临床研究的方案确定。MSC相关疗效的关键影响因素依次排列为以下四个:细胞质量、注射途径、治疗时机、最佳剂量。
细胞质量[2]
不同厂家生产出来的同一种细胞产品,质量之间肯定存在一些差异,尤其是进口产品和国内产品。同样的情况也存在于相同厂家所生产的不同批次之间。我认为细胞质量指单位细胞或单个细胞所对应的生物学效力,效力越高,细胞质量越好。我们应该在一个适应症范围内谈论这个效力如何,比如,MSC同时具有免疫抑制和促进血管再生的功能,分别治疗两大类不同的疾病,那么相对应的就有两个生物学效力指标。我们需要明确在讨论MSC的细胞质量或生物学效力时,一定离不开具体的适应症。
一些共识参数可以反映间充质干细胞的质量,比如细胞活率、供体特性、克隆形成能力、细胞大小、免疫抑制能力和细胞因子分泌量。可以说细胞质量是治疗成败最为关键的因素。
注射途径[3]
局部注射途径:常见局部注射MSC的部位有脑部、四肢肌肉、心脏、肝脏、腰椎(蛛网膜下腔)。局部微注射人骨髓MSC到大鼠大脑纹状体,72天后依然能检测到它的存在,而且MSC能迁移至胼胝体和大脑皮层。大脑右侧尾状核局部注射MSC,4周后大脑多个部位均可检测到MSC的存在,而且发现MSC在大脑的迁移偏好于沿着血管的走向。
全身注射途径:常见全身注射MSC的部位有腹腔、静脉和动脉注射。MSC腹腔注射免疫缺陷的小鼠(裸鼠和NOD/SCID小鼠)后,在体内多组织器官中存在可达120天,而MSC在免疫系统健全的异品种小鼠只能存在20多天,但是可以在同品种小鼠中存在40多天(见图2)。静脉注射MSC后,大部分的MSC滞留在肺部,然后随着血流达到肝脏、肾脏、脾脏。MSC注射1小时后,50-60%的MSC滞留在肺部,3个小时后将至30%,并维持到96个小时。滞留在肺部的MSC可以被局部微环境所激活分泌大量的抗炎因子,这些抗炎因子随血流分布到达全身,有利于减轻全身炎症、调节免疫。
狒狒实验证明骨髓MSC经外周静脉注射后,自体MSC和异体MSC在体内的分布没有明显差异,且年龄越大的供体,其骨髓MSC越容易在肺部滞留(在肺部滞留的MSC数量与其细胞表面表达的整合素α4和α6密切相关,表达量越高,越不容易在肺部滞留)。动脉注射可以使MSC直接到达并集中于病灶区,减少损耗。但是颈内动脉注射后,MSC在脑部的存活时间一般不超过2天。
不同的注射途径(局部注射、静脉注射、动脉注射)均对MSC在体内的存留时间产生较大的影响,并与MSC的清除速度密切相关。
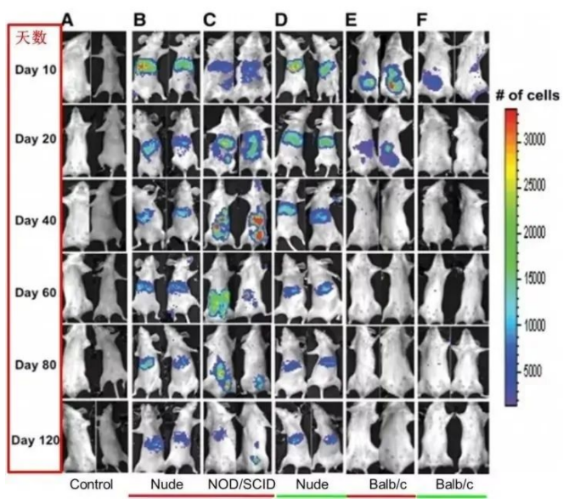
图2:MSC腹腔注射免疫缺陷的小鼠裸鼠和NOD/SCID小鼠后分布
治疗时机[4-6]
急性肝功能衰竭的猪实验发现,严重的炎症环境限制了MSC的效果,因为MSC在严重炎症的肝脏环境中存活率低。MSC未能提高伴有全身性炎症的急性和慢性肝功能衰竭患者的存活率,但是减轻炎症明显有利于提高MSC的治疗效果。在另一项MSC治疗儿童激素难治性GVHD的多中心临床研究中,MSC在疾病早期介入治疗比晚期治疗更有效。这些数据清楚地表明,严重的炎症环境可能会减弱MSC的治疗效果。
目前细胞治疗有三个充满希望的预期:(1)亚临床患者在病程早期或确定为高危患者时,可进行预防性治疗;(2)临床患者可接受预防治疗,以减轻疾病进展;(3)进展期患者应在灾难性器官实质丢失前接受治疗。且所有治疗策略的制定都需要充分权衡临床获益与副作用的大小。为确保预期的治疗效果,在开始治疗时,要根据初始危险分层(极高危、高危或低危),充分评估机体所处炎症状态,再选择MSC的治疗策略和时机才是审慎的做法。
最佳剂量[7]
目前的临床研究中,在MSC的使用剂量差别非常大,每名患者使用的MSC细胞数从四千多~上亿个MSC不等。2020年10月Gaetano等发表于medicina上的《Mesenchymal Stromal Cell Therapy in the Management of Perianal Fistulas in Crohn's Disease》一文,对2013-2020年间针对克罗恩病(CD)的试验进行总结(如图3)中发现:骨髓间充质用量在3*107的试验剂量组,其收获的疗效高于低剂量给药组(1*107)及低剂量给药组(9*107);在park et等所应用脂肪来源的间充质观察中同样看到低剂量给药组(4.33*107)的疗效大于高剂量给药组(17*107)。
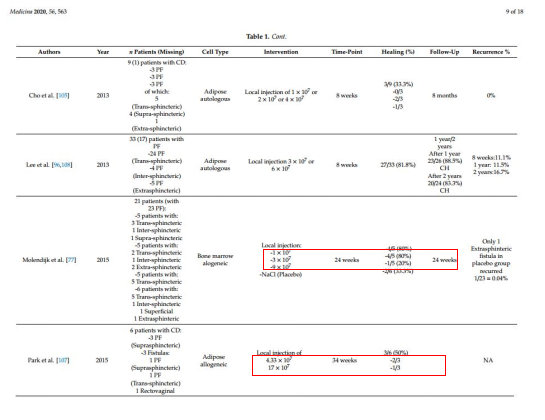
图3:2013-2020年间针对克罗恩病(CD)的试验
这一现象绝非偶然,进一步研究表明在提取和扩增后,间充质干细胞最佳剂量组在遗传和形态上更加稳定,并显示出更大的增殖能力和血管生成特性[8-10]。此外,最大的优势在于组织生长因子的高表达,降低了血液相容性[11]。其研究的结论是:MSC的最佳剂量取决于不同的疾病、疾病当下所处的严重程度以及输入途径。
目前,确保合理用药,保障患者用药安全、有效、经济,已成为医疗机构不容回避的问题。为避免MSC引起的不良反应,细胞产品的生产厂家确保细胞质量固然重要,而临床正确使用则更为关键。医师要高度重视超量使用问题,加强专业理论学习,加强病案讨论,落实有关规章制度,为临床MSC合理使用保驾护航。
俗话说“病来如山倒,病去如抽丝”,间充质干细胞的临床应用就似春雨一般,勿需惊雷,但需恰到好处。正是这一句“好雨知时节,润物细无声。”
参考文献:
[1]2019-novel coronavirus (2019-nCoV) infections trigger an exaggerated cytokine response aggravating lung injury
[2]Analysis of Oct4‐Dependent Transcriptional Networks Regulating Self‐Renewal and Pluripotency in Human Embryonic Stem Cells
[3]Cell Delivery Routes for Stem Cell Therapy to the Heart: Current and Future Approaches
[4]Impact of Timing on Efficacy and Safetyof Intracoronary Autologous Bone Marrow Stem Cells Transplantation in Acute Myocardial Infarction: A Pooled Subgroup Analysis of Randomized Controlled Trials
[5]Timing and cell dose determine therapeutic effects of bone marrow stromal cell transplantation in rat model of cerebral infarct
[6]Into the Eye of the Cytokine Storm
[7]Mesenchymal Stromal Cell Therapy in the Management of Perianal Fistulas in Crohn's Disease An Up-To-Date Review
[8]Kim, Y.; Kim, H.; Cho, H.; Bae, Y.; Suh, K.; Jung, J. Direct comparison of human mesench-ymal stem cells derived from adipose tissues and bone marrow inmediating neovascularization in response to vascular ischemia. Cell Physiol. Biochem. 2007, 20, 867–876. [CrossRef] [PubMed]
[9] Kern, S.; Eichler, H.; Stoeve, J.; Klüter, H.; Bieback, K. Comparative analysis of mesench-ymal stem cells from bone marrow, umbilical cord blood, or adi-pose tissue. Stem Cells 2006, 24, 1294–1301. [CrossRef]
[10] Izadpanah, R.; Trygg, C.; Patel, B.; Kriedt, C.; Dufour, J.; Gimble, J.M.; Bunnell, B.A. Biologic properties of mesench-ymal stem cells derived from bone marrow and adipose tissue. J. Cell Biochem. 2006, 99, 1285–1297. [CrossRef] [PubMed
[11] Nikolic, M.; Stift, A.; Reinisch, W.; Vogelsang, H.; Matic, A.; Müller, C.; von Strauss und Torney, M.; Riss, S. Allogeneic expanded-adipose derived stem cells in the treatment of rectovaginal fistulas in Crohn’s disease. Colorectal Dis. 2020. [CrossRef]